Enzymwirkung
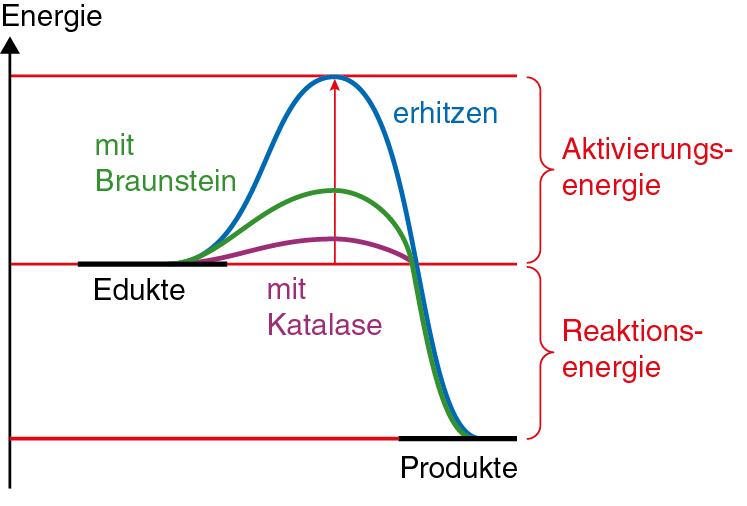
- Wasserstoffperoxid ist eine metastabile Verbindung, der Zerfall ist zwar eine exotherme/exergonische Reaktion, jedoch setzt er ohne Zufuhr von Aktivierungsenergie nicht ein bzw. ist sehr langsam. Durch Erhitzen wird die Reaktion stark beschleunigt: Die zugeführte Wärme stellt die nötige Aktivierungsenergie zur Verfügung. Braunstein (MnO2) ist ein Katalysator dieser Reaktion; wird er zugegeben, so beschleunigt sich die Sauerstoffentwicklung erheblich, weil die benötigte Aktivierungsenergie herabgesetzt wird. Lebende Zellen enthalten ein für diese Reaktion spezifisches Enzym, die Katalase. Unter der Wirkung dieses Enzyms läuft der H2O2-Zerfall äußerst schnell ab.
- Alle drei Ansätze laufen weiter, wie beschrieben. Katalysatoren, auch Enzyme, werden bei der Reaktion nicht verbraucht.
- Die Ansätze 1 und 2 verlaufen unverändert. Der dritte Versuch jedoch hat ein ganz anderes Ergebnis: Das Wasserstoffperoxid zerfällt nicht. Quecksilbersalze/Hg2+-Ionen sind sehr starke Enzymgifte. Sie brechen die Disulfidbrücken im Enzymprotein auf (weil sie mit Schwefel stabile Verbindungen eingehen). Damit ändern sie die Struktur der Enzymmoleküle, deren Aktivität erlischt.
Wissensteil:
Enzyme sind Biokatalysatoren. Sie
- beschleunigen biochemische Reaktionen. Der Zerfall von H2O2 wird durch die Katalase um den Faktor 107 beschleunigt!
- setzen die Aktivierungsenergie der Reaktionen herab. So ermöglichen sie Reaktionen bei Körpertemperatur, die sonst erst bei sehr hohen Temperaturen ablaufen.
- ändern nicht die Lage des Gleichgewichtes einer Reaktion.
- wirken in kleinsten Mengen und verbrauchen sich bei einer Reaktion nicht.
- sind wirkungsspezifisch (reaktionsspezifisch): Sie katalysieren i.A. nur eine ganz bestimmte Reaktion.
- sind substratspezifisch: Sie setzen nur ganz bestimmte Substanzen um, oft nur eine einzige.
- wirken innerhalb und ausserhalb von lebenden Zellen.

Die Katalase ist ein eisenhaltiges Enzym, das in fast allen aerob lebenden Mikroorganismen, in Pflanzen und allen tierischen Organen vorkommt, insbesondere in den Peroxisomen der Leber. Auch rote Blutkörperchen (Erythrozyten) sind reich an Katalase. Messungen der Katalaseaktivität sind häufig und wichtig in den Ernährungswissenschaften und in der industriellen Nahrungsmittelherstellung.
Der systematische Name lautet Wasserstoffperoxid-Oxidoreduktase. Katalase beseitigt das starke Zellgift Wasserstoffperoxid (H2O2) durch Zerlegung in Sauerstoff (O2) und Wasser (H2O). Die Reaktionsgleichung lautet: 2H2H2 → O2 + 2H2O. Die Aktivierungsenergie für die H2O2 -Zersetzung durch Katalase ist sehr niedrig.
Jede Untereinheit des aus vier identischen Untereinheiten bestehenden Enzyms enthält eine Häm-Gruppe im aktiven Zentrum. An das Eisenatom des Komplexes wird das H2O2 -Molekül gebunden und dann gespalten. 1ml Blut enthält etwa 60µg Katalase. Dennoch läuft nach Zugabe eines Bluttropfens zu einer Wasserstoffperoxidlösung die Reaktion viel schneller ab als bei Zugabe einerEisen(III)chlorid-Lösung, deren Eisen-Konzentration um den Faktor 103 höher liegt. Dies zeigt, dass Katalase eine außerordentlich hohe Aktivität aufweist. Sowohl Wechselzahl als auch katalytische Effizienz des Enzyms gehören zu den höchsten je bei Enzymen gefundenen Werten.

