Essigreiniger
- Die Grafik finden Sie im Wissensteil!
- Der Äquivalenzpunkt der Titration liegt bei einer Zugabe von 10,2 ml Natronlauge.
Aus der Reaktionsgleichung:
1 HAc + 1 NaOH → NaAc + H2O
ergibt sich für das Stoffmengenverhältnis:
n(HAc) / n(NaOH) = 1 / 1
Weiterhin gilt: n = c·V
Damit ergibt sich:
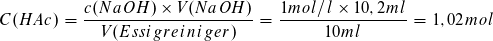
Die Stoffmengenkonzentration des Essigreinigersbeträgt: c (HAc) = 1,02 mol/l.
Für den Massenanteil gilt:
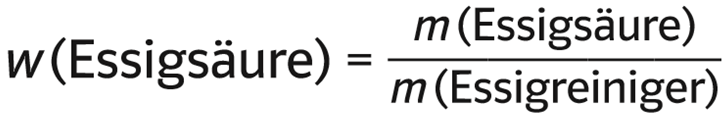
m (Essigs. in 1 l Essigreiniger)
= n (HAc)·M(HAc)
= 1,02 mol · 60 g/mol
= 61,2 g
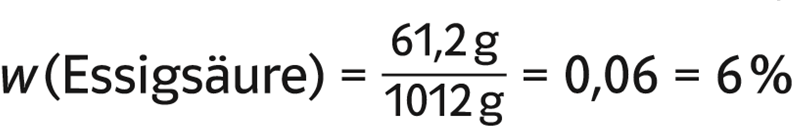
Wissensteil:
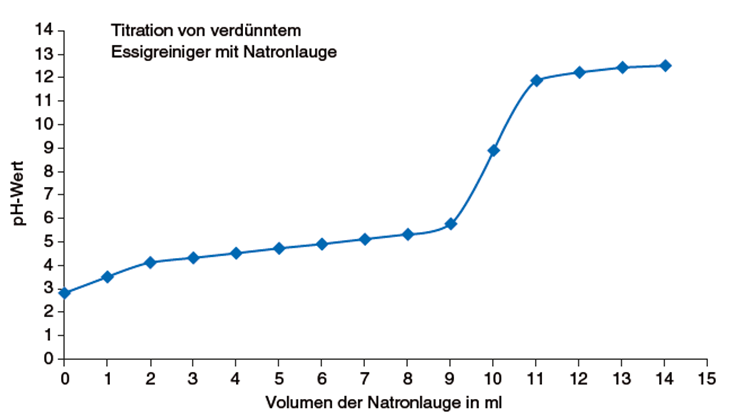
Beschreibung und Deutung der Titrationskurve
Die Titrationskurve beginnt bei einem pH-Wert pH = 2,8. Die Kurve verläuft bis zur Zugabe von ca. 9 ml Natronlauge flach, d. h., der pH-Wert verändert sich wenig. Nach der Zugabe von 9 ml Natronlauge erfolgt ein pH-Sprung von 5,7 auf 11,8 bei der Zugabe von 11 ml Natronlauge. Nach weiterer Zugabe der Natronlauge verläuft die Kurve wieder flach, der pH-Wert verändert sich nur wenig.
Erklärung des Kurvenverlaufs
Der pH-Wert der Ausgangslösung hängt von der Säurestärke und der Konzentration der Essigsäure ab. Die schwache Säure, die Essigsäure, reagiert mit der Natronlauge. Die Reaktionsgleichung lautet:
HAc + OH- → Ac- + H2O bzw. CH3COOH + OH- → CH3 COO- + H2O
Am Äquivalenzpunkt, an dem die Stoffmenge der Essigsäure n (HAc) der Stoffmenge des zugegebenen Natriumhydroxids n (NaOH) entspricht, liegt bei einer Zugabe von etwa 10,2 ml Natronlauge, der pH-Wert ist pH ≈ 9. Der Äquivalenzpunkt fällt also nicht mit dem Neutralpunkt pH = 7 zusammen. Dieses liegt daran, dass am Äquivalenzpunkt eine Natriumacetat-Lösung vorliegt. Die Acetationen reagieren in einer Gleichgewichtsreaktion in geringem Ausmaß mit dem Wasser:
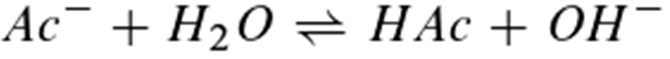
Die Lösung ist deshalb am Äquivalenzpunkt alkalisch. Der pH-Wert wird bei weiterer Zugabe der Natronlauge im Wesentlichen durch die OH- -Ionen der Natronlauge bestimmt.
Bei einer Zugabe von etwa 5,1 ml Natronlauge liegt der Halbäquivalenzpunkt vor.
Für diesen Punkt gilt: c (H3O+ ) = Ks bzw. pH = pKs. Der pH-Wert liegt hier zwischen 4,7 und 4,8, also liegt der Ks -Wert zwischen 10-4,7 mol/l und 10-4,8 mol/l bzw. der pKs -Wert zwischen 4,7 und 4,8.

