Essigsäure im Essig
- Die Grafik finden Sie im Wissensteil!
Der Graph besteht aus zwei Geraden, die bei der Zugabe von V (Natronlauge) = 9 ml einen Schnittpunkt aufweisen. Hier liegt der Äquivalenzpunkt.
- Wegen 1 HAc + 1 NaOH → NaAc + H2O ergibt sich für das Stoffmengenverhältnis:
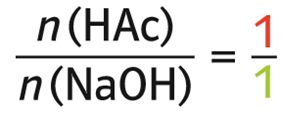
n = c·V

Die Stoffmengenkonzentration im Essig ist damit:
c (HAc) = 0,9 mol/l
m (Essigsäure) = n·M (HAc) = c·V·M (HAc)
= 0,9 mol/l·1 l·60 g/mol = 54 g
Die Massenkonzentration der Essigsäure im Essig beträgt damit β (Essigsäure) = 54 g/l.
Wissensteil:
Deutung der Leitfähigkeitsgrafik von Essigsäure im Essig

Der Graph besteht aus zwei Geraden, die bei der Zugabe von V (Natronlauge) = 9 ml einen Schnittpunkt aufweisen. Hier liegt der Äquivalenzpunkt. Die Steigung der ersten Geraden ist kleiner als die der zweiten Geraden.
Vor der ersten Zugabe der Natronlauge wird die elektrische Leitfähigkeit der Lösungen von der geringen Konzentration an Acetat- und Oxoniumionen bestimmt. Essigsäure ist eine schwache Säure.
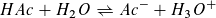
Bei der Zugabe der Natronlauge reagiert die Essigsäure mit der Natronlauge
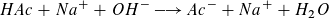
Die elektrische Leitfähigkeit wird von der Acetationen-, der Natriumionen- und der Oxoniumionenkonzentration bestimmt. Am Äquivalenzpunkt wird die Leitfähigkeit im Wesentlichen von der Acetat- und Natriumionenkonzentration bestimmt. Die Oxonium- und Hydroxidionenkonzentration aus dem Ionenprodukt des Wassers ist am Äquivalenzpunkt sehr klein. Nach dem Erreichen des Äquivalenzpunktes kommen zusätzlich Natrium- und Hydroxidionen in die Lösung und erhöhen die elektrische Leitfähigkeit.
Die elektrische Leitfähigkeit ist abhängig von der Ionensorte (ihrer Ladung, ihrer Beweglichkeit) und ihrer Konzentration. Die Gesamtleitfähigkeit einer Lösung ergibt sich additiv aus den Leitfähigkeiten der Ionen. Besonders große Ionenbeweglichkeiten und damit auch Leitfähigkeiten weisen die Oxoniumund die Hydroxidionen auf.

